Un nouveau venu dans la régulation du monoxyde d’azote endothélial
https://www.medecinesciences.org/en/articles/medsci/full_html/2013/06/medsci2013295p471/medsci2013295p471.html
Article en libre accès
Les molécules de signalisation rédox, santé holistique et naturelle
https://www.presencenaturo.com/fr/les-molecules-de-signalisation-redox-sante-holistique-et-naturelle/

PERPLEXITY / IA
Lp(a) modifie la signalisation nitrosative endothéliale en favorisant le découplage d’eNOS, le basculement de la production de NO vers le superoxyde, puis la formation accrue de peroxynitrite, ce qui inverse le rapport NO/ONOO⁻ au profit d’un signal nitroxydatif délétère. Cette dérégulation s’accompagne d’une reprogrammation transcriptionnelle vasculaire vers des profils pro‑inflammatoires et pro‑athérogènes.
Découplage d’eNOS induit par Lp(a)
Une élévation génétiquement déterminée de Lp(a) s’associe à une augmentation du superoxyde artériel due principalement à un eNOS découplé, sans accroissement significatif du superoxyde issu des NOX vasculaires.
Ce découplage est lié à une baisse de la biodisponibilité de la tétrahydrobioptérine (BH4), avec diminution du ratio BH4/BH2, de sorte qu’eNOS produit simultanément NO et O2- −, devenant une source de peroxynitrite plutôt qu’une enzyme vasoprotectrice.
Bascule du signal NO vers ONOO⁻
Quand NO et O2- − sont générés au même endroit, ils réagissent rapidement pour former du peroxynitrite (ONOO⁻), qui prend alors le contrôle de l’environnement redox et nitrosatif endothélial lorsque le rapport NO/ONOO⁻ devient inférieur à 1.
Dans ce contexte, les fonctions classiques du NO (vasodilatation, effet anti‑adhésif, freinage de l’activation plaquettaire) sont fortement diminuées, tandis que la nitration et la S‑nitrosylation aberrantes de protéines endothéliales augmentent, favorisant dysfonction endothéliale et inflammation.
Reprogrammation transcriptionnelle et inflammation vasculaire
Chez les patients avec Lp(a) élevée, l’ARN‑seq de tissu artériel montre une dérégulation de voies de signalisation nitrosative et inflammatoire, en lien avec l’augmentation de superoxyde vasculaire, indépendamment des marqueurs systémiques classiques d’inflammation et de stress oxydatif.
Ainsi, Lp(a) agit comme modulateur local de la signalisation nitrosative endothéliale, en créant un microenvironnement dominé par le peroxynitrite et les dérivés nitrants, qui entretient un phénotype endothélial pro‑inflammatoire, pro‑athérogène et pro-thrombotique.
Polkinghorne MD, Badi I, Baragetti A, Chauhan J, Xie C, Wahome E, Akoumianakis I, Foran D, Patel P, de Araujo E, Kotanidis CP, Krasopoulos G, Sayeed R, Srivastava V, Kourliouros A, Walcot N, Sastry P, Guzik T, Channon KM, Norata GD, Antoniades C. Lipoprotein(a) and Vascular Redox State in Patients With Advanced Coronary Atherosclerosis. Lipoprotéine (a) et état redox vasculaire chez les patients atteints d'athérosclérose coronarienne avancée, Arterioscler Thromb Vasc Biol. 2025 Oct 30. doi: 10.1161/ATVBAHA.125.322924. Epub ahead of print. PMID: 41164877.
https://www.ahajournals.org/doi/10.1161/ATVBAHA.125.322924
Contexte
La Lp(a) (lipoprotéine [a]) est associée aux maladies cardiovasculaires, mais ni sa nature causale ni les mécanismes sous-jacents ne sont entièrement élucidés. Cette étude a examiné si la Lp(a) déclenche l’athérogenèse en dérégulant l’état inflammatoire vasculaire sensible au potentiel redox.
Méthodes
Le taux plasmatique de Lp(a) a été mesuré chez 1 027 patients atteints d’une maladie coronarienne avancée et candidats à une chirurgie cardiaque. Le génotype de ces patients a été déterminé, et un score de risque génétique LPA modifié, permettant de calculer les taux de Lp(a), a été établi. Le séquençage de l’ARN et le dosage du superoxyde vasculaire ont été réalisés dans les artères mammaires internes, et la contribution des NOX (NADPH oxydases) et de l’eNOS (oxyde nitrique synthase endothéliale) découplée a été déterminée. La durée médiane du suivi était de 5,07 ans.
Résultats
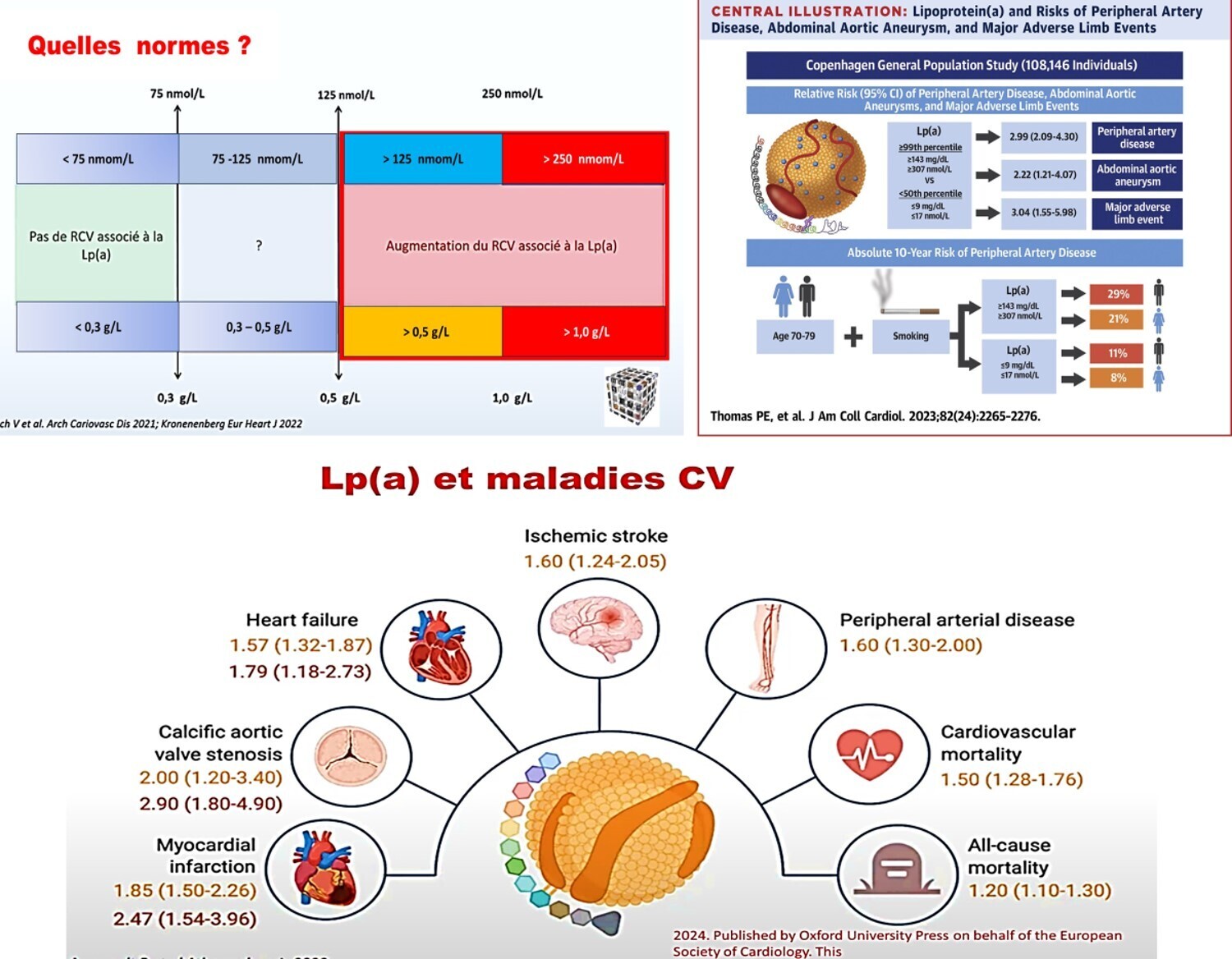
Une augmentation du taux plasmatique de Lp(a) ( p = 0,03) et du score de risque génétique LPA ( p = 0,01) était associée à une élévation du superoxyde artériel dans l’ensemble de la population étudiée, un effet principalement observé chez les patients non diabétiques. Cet effet était principalement dû au découplage de l’eNOS via une biodisponibilité réduite de la tétrahydrobioptérine vasculaire. La variabilité du taux de Lp(a) n’avait pas d’impact significatif sur le superoxyde vasculaire dérivé de la NOX ( p = 0,13). Le séquençage de l’ARN du tissu artériel a révélé une dérégulation des voies de signalisation nitrosative et inflammatoire chez les patients présentant un taux élevé de L. En revanche, aucune association n’a’ait été observée avec les biomarqueurs systémiques de l’inflammation (par exemple, la protéine C-réactive ultrasensible [hsCRP] ; p = 0,82) ou du stress oxydatif (par exemple, le malondialdéhyde ; p = 0,61). Enfin, le score de risque génétique LPA (risque relatif : 3,615 [IC à 95 % : 1,044-12,515] ; p = 0,043) et un taux plasmatique élevé de Lp(a) (risque relatif : 3,286 [IC à 95 % : 1,003-10,767] ; p = 0,049) étaient tous deux associés à un risque accru de mortalité cardiaque. Cette association était dépendante du superoxyde vasculaire, suggérant qu’une signalisation inflammatoire sensible au potentiel redox pourrait constituer un lien entre la Lp(a) et le risque cardiovasculaire. Toutes ces associations étaient indépendantes du taux plasmatique d’ApoB (apolipoprotéine B).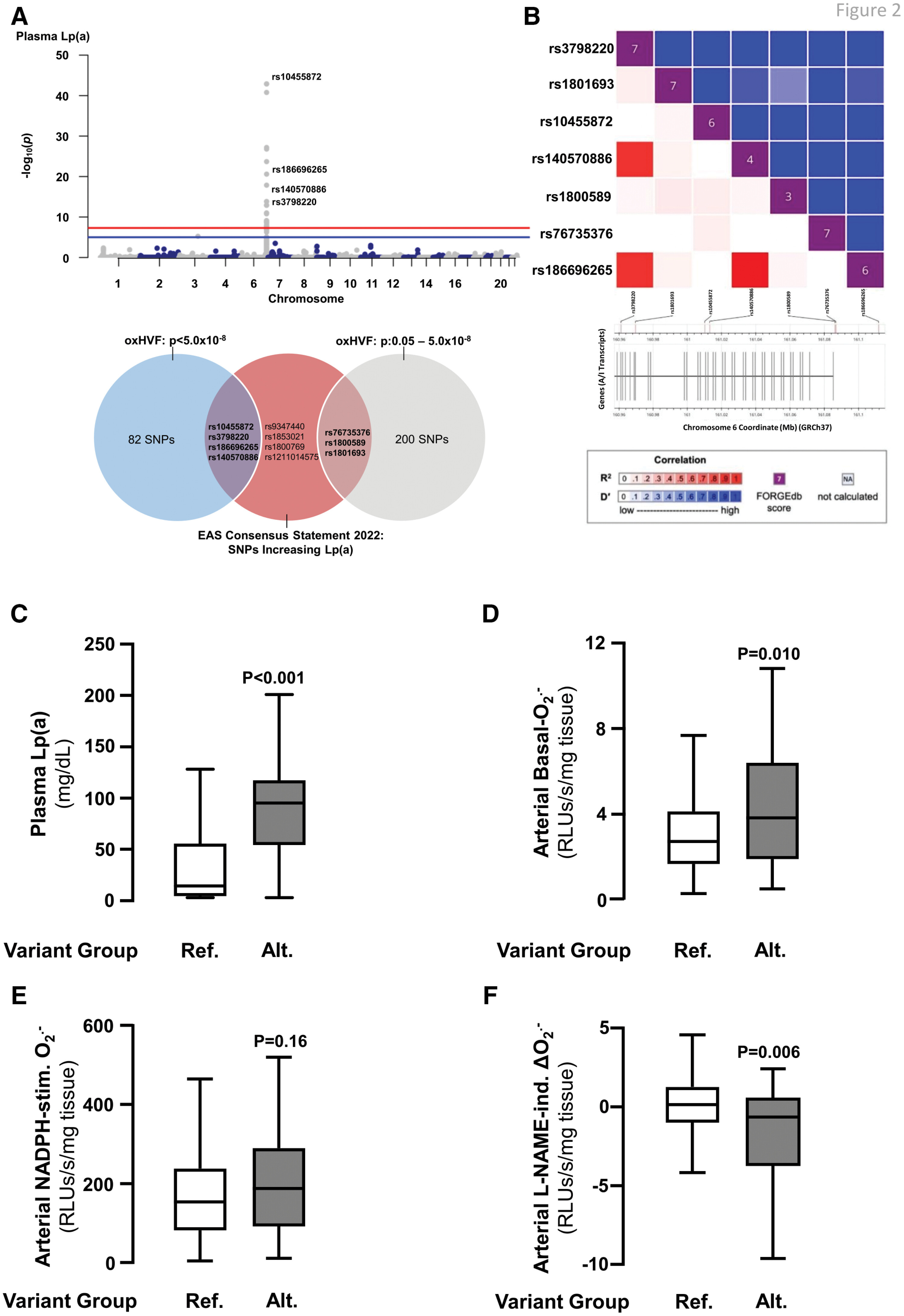
Le score de risque génétique (SRG) LPA est associé à une production accrue de superoxyde artériel (O₂⁻ ) .
A , Sept SNP ont été inclus dans le SRG LPA. La ligne rouge indique la significativité à l'échelle du génome après correction pour tests multiples par la méthode du taux de faux positifs.
B. Les statistiques de déséquilibre de liaison (DL) pour ces variants sont représentées par coordonnées génomiques sur les axes x et y, formant un graphique carré indiquant R² en dessous (en rouge) et D' au-dessus (en bleu) du score FORGEdb pour chaque variant (en violet). Les patients du groupe de variants alternatifs du SRG LPA présentaient des taux plasmatiques de Lp(a) (lipoprotéine [a]) significativement plus élevés (n = 666 ;
C ) que les patients du groupe de variants de référence. Comparés à ceux du groupe de variants de référence du SRG LPA, les patients du groupe de variants alternatifs présentaient une production basale artérielle d'O₂⁻ significativement plus élevée ( n = 302 ;
D ). De plus, malgré l'absence de différence significative dans la production de NOX (NADPH oxydase)-O₂⁻ ( n=297 ;
E ), les patients du groupe présentant la variante alternative du score de risque génétique LPA (LPA GRS) par rapport au groupe de référence présentaient une augmentation significative de la production d'O₂⁻ dérivé de l'eNOS (oxyde nitrique synthase endothéliale) ( n = 267 ;
F ). Alt. : alternative ; Ind. : induite ; Med. : moyenne ; Ref. : référence ; RLU : unité relative de lumière.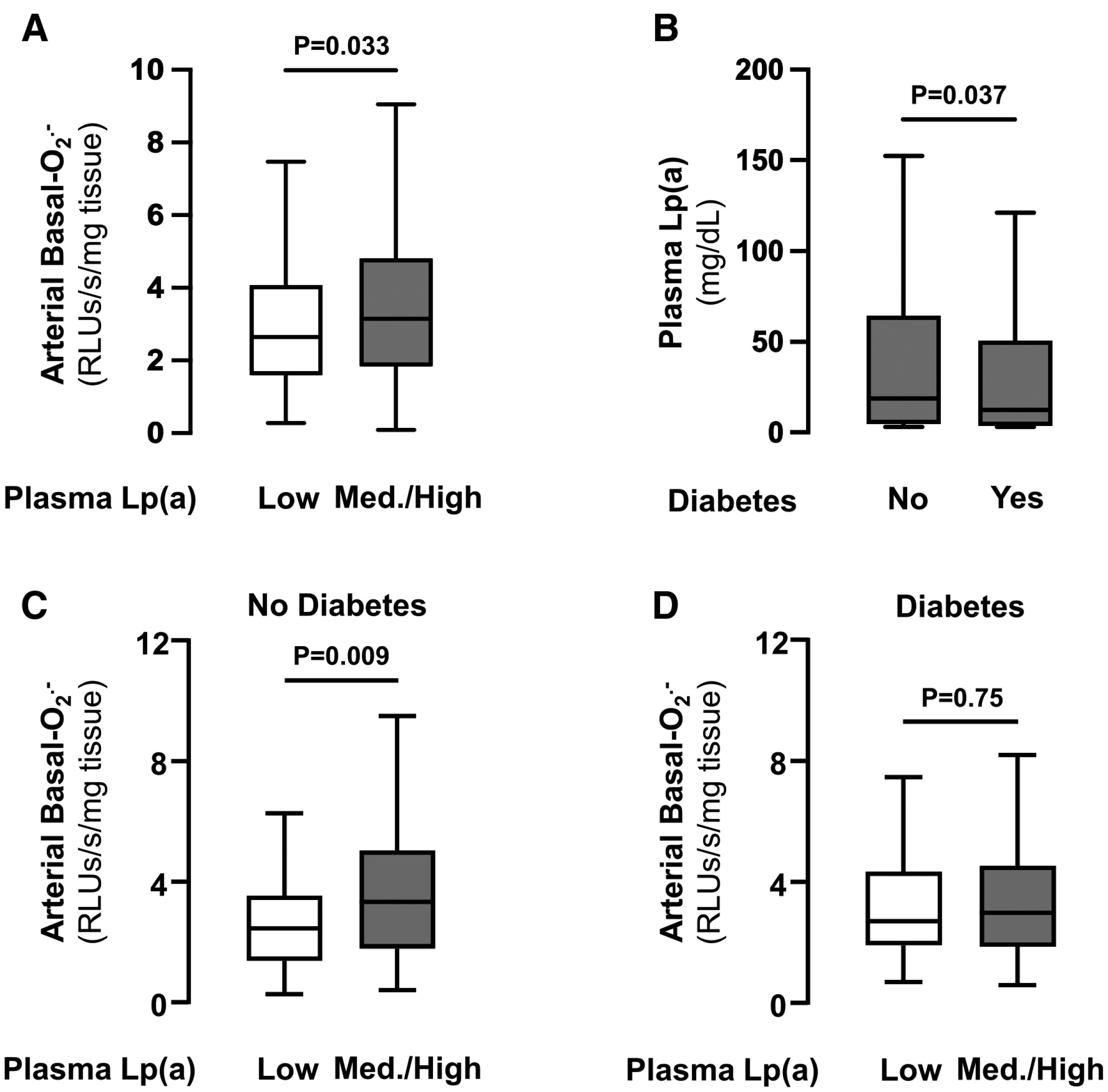
La Lp(a) (lipoprotéine [a]) augmente la production artérielle de superoxyde (O₂⁻ ) chez les non-diabétiques, mais pas chez les diabétiques. Dans l'ensemble de la population étudiée (n = 411 ; A), les patients présentant des taux moyens/élevés de Lp(a) avaient une production artérielle basale d'O₂⁻ significativement plus élevée que ceux présentant de faibles taux plasmatiques de Lp( a ). Les patients diabétiques présentaient des taux plasmatiques de Lp(a) significativement plus faibles que les non-diabétiques (n = 947 ; B ). Chez les patients non diabétiques (n = 147 ; C ), les taux moyens/élevés de Lp(a) avaient une production artérielle basale d'O₂⁻ significativement plus élevée que ceux présentant de faibles taux plasmatiques de Lp(a). Chez les patients diabétiques, aucune différence significative de production artérielle basale d'O₂⁻ n'a été observée entre les patients présentant des taux plasmatiques de Lp(a) moyens/élevés et ceux présentant de faibles taux plasmatiques de Lp(a) (n = 149 ; D ). « Med » indique un taux moyen. et RLU, unité relative de lumière.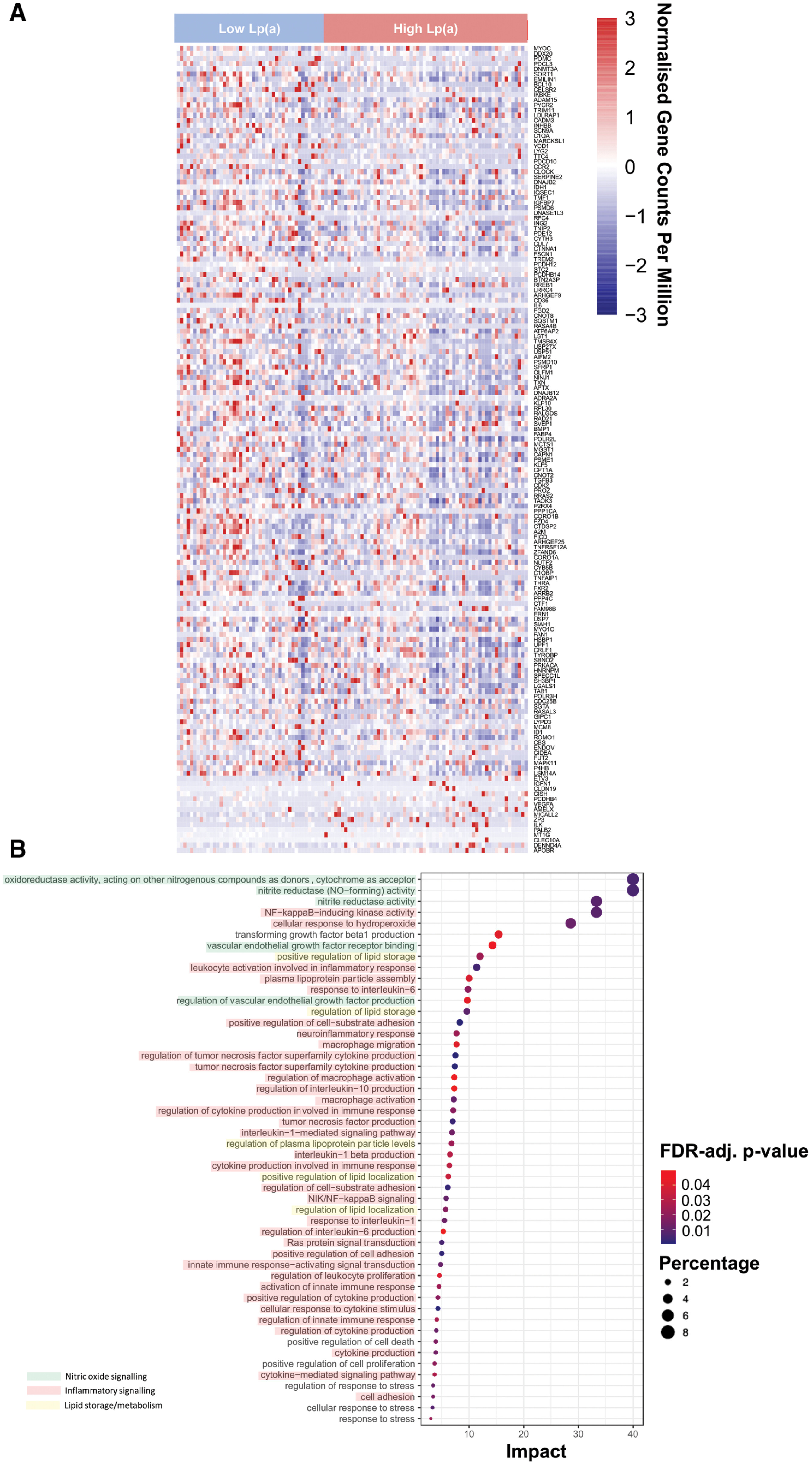
Voies de signalisation reliant la Lp(a) (lipoprotéine [a]) et le dérèglement du potentiel redox vasculaire. Cartes thermiques des gènes les plus significativement différentiellement exprimés (GDE ; après correction pour tests multiples par la méthode du taux de faux positifs [FDR]) chez les patients non diabétiques présentant des taux plasmatiques de Lp(a) élevés ou faibles (n = 108 ; A ). Les 50 voies d’ontologie génique les plus importantes ont été classées par ordre d’impact à partir d’une analyse d’enrichissement de gènes de ces GDE, qui a identifié des voies significativement enrichies chez tous les patients présentant des taux plasmatiques de Lp(a) élevés ou faibles (n = 108 ; B ). La couleur des nœuds est basée sur la valeur p ajustée par FDR (FDR-adj.) , et leur rayon est déterminé en fonction de l’impact des voies. Les voies à fortconcernéespliquées dans la signalisation de l’oxyde nitrique/la fonction endothéliale sont mises en évidence en vert, celles impliquées dans la signalisation inflammatoire en rouge et celles impliquées dans le stockage/métabolisme des lipides en jaune.
Conclusions
Cette étude démontre pour la première fois qu'une augmentation génétiquement déterminée du Lp(a) plasmatique entraîne une dérégulation de la signalisation redox/nitrosative vasculaire chez les patients atteints d'athérosclérose.
RESUME GENERATIF
Ce document traite de l'impact de la lipoprotéine (a) sur l'état redox vasculaire et l'inflammation chez les patients atteints d'athérosclérose coronarienne avancée.
Lp(a) et état vasculaire chez les patients
Cette étude examine l'impact de Lp(a) sur l'inflammation vasculaire et le risque cardiovasculaire chez des patients atteints d'athérosclérose avancée.
- * Lp(a) est associé à des maladies cardiovasculaires, mais les mécanismes sous-jacents ne sont pas entièrement compris.
- * L'étude a mesuré les niveaux de Lp(a) chez 1027 patients subissant une chirurgie cardiaque.
- * Un score de risque génétique modifié a été créé pour évaluer les niveaux de Lp(a).
- * Les résultats montrent que des niveaux élevés de Lp(a) sont liés à une augmentation de la production de superoxyde dans les artères, principalement chez les non-diabétiques.
- * L'augmentation du superoxyde est due à un déséquilibre de la bio-disponibilité de la tétrahydrobioptérine, entraînant un découplage de l'eNOS.
Méthodologie de l'étude
Cette section décrit la population étudiée et les méthodes utilisées pour collecter et analyser les données.
- * 1027 patients avec une maladie coronarienne avancée ont été recrutés pour l'étude.
- Des échantillons de sang ont été prélevés avant la chirurgie pour mesurer Lp(a) et d'autres biomarqueurs.
- * Des biopsies artérielles ont été prélevées pour évaluer la production de superoxyde et effectuer des analyses de séquençage d'ARN.
- * Les analyses statistiques ont été réalisées pour déterminer les associations entre Lp(a) et l'état vasculaire.
Résultats démographiques des patients
Cette section présente les caractéristiques démographiques des patients inclus dans l'étude.
- * L'âge médian des patients était de 67,05 ans, avec 81,9 % d'hommes.
- * 20,9 % des patients étaient diabétiques, et des différences significatives ont été observées entre les groupes diabétiques et non-diabétiques.
- * Les niveaux de Lp(a) étaient significativement plus élevés chez les non-diabétiques (18,3 mg/dL) par rapport aux diabétiques (12,6 mg/dL).
- * D'autres facteurs de risque, tels que l'hypertension et l'hypercholestérolémie, étaient également plus fréquents chez les diabétiques.
Impact de Lp(a) sur l'état oxydatif vasculaire
Cette section explore la relation entre les niveaux de Lp(a) et la production de superoxyde dans les artères.
- * Les patients avec des niveaux élevés de Lp(a) avaient une production de superoxyde artériel significativement plus élevée.
- * L'augmentation de la production de superoxyde était principalement due à un découplage de l'eNOS, et non à une augmentation de l'activité des NOX.
- * Les niveaux de tétrahydrobioptérine étaient réduits chez les patients avec des niveaux élevés de Lp(a), ce qui contribue au découplage de l'eNOS.
Analyse de la Randomisation Mendélienne
Cette section discute de l'utilisation de la randomisation mendélienne pour établir un lien causal entre Lp(a) et l'état vasculaire.
- * Un score de risque génétique a été utilisé pour évaluer l'impact de Lp(a) sur la production de superoxyde.
- * Les résultats montrent que la variabilité génétique de Lp(a) est associée à une augmentation de la production de superoxyde, indépendamment des niveaux d'ApoB.
- * L'analyse a confirmé que l'association entre Lp(a) et l'état vasculaire est robuste et non influencée par des facteurs de confusion.
Conclusions de l'étude
Cette section résume les conclusions principales de l'étude.
- * L'augmentation génétiquement déterminée de Lp(a) entraîne une dysrégulation de la signalisation redox vasculaire chez les patients atteints d'athérosclérose.
- * Les résultats suggèrent que Lp(a) pourrait être un facteur de risque modifiable pour les événements cardiovasculaires.
- * Des recherches supplémentaires sont nécessaires pour explorer les mécanismes sous-jacents et l'impact des thérapies visant à réduire Lp(a).
Association entre Lp(a) et état redox vasculaire
Cette étude démontre que Lp(a) est lié à la production d'O₂⁻ dans les artères, indépendamment de l'ApoB et d'autres facteurs de risque cardiovasculaire.
- * Lp(a) est associé à une dysrégulation redox vasculaire, principalement chez les individus sans diabète.
- * Une analyse transcriptomique a révélé 157 gènes exprimés différemment entre les patients avec des niveaux élevés et faibles de Lp(a).
- * Les voies enrichies sont principalement liées à la signalisation de l'oxyde nitrique et aux réponses inflammatoires vasculaires.
- * Les gènes CBS, CYB5B et MGST1, impliqués dans l'activité antioxydante, sont down-régulés chez les patients avec des niveaux élevés de Lp(a).
Lp(a) et mortalité cardiovasculaire
Lp(a) est associé à un risque accru de mortalité cardiovasculaire, indépendamment de l'ApoB.
- * Les patients avec un groupe de variantes génétiques LPA alternatives ont un risque de mortalité cardiovasculaire significativement plus élevé (HR, 3,62).
- * Les niveaux de Lp(a) moyens/élevés sont également liés à un risque accru de mortalité cardiovasculaire (HR, 3,286).
- * L'association entre Lp(a) et la mortalité cardiovasculaire est médiée par la production d'O2.− dans les artères.
Mécanismes sous-jacents de Lp(a) dans l'athérosclérose
Lp(a) joue un rôle direct dans la dysrégulation de la signalisation inflammatoire redox dans la paroi artérielle.
- * L'oxydation de la tétrahydrobioptérine entraîne un découplage de l'eNOS, augmentant la production d'O₂⁻.
- * Lp(a) est associé à une réduction de la biodisponibilité de la tétrahydrobioptérine et à une augmentation du découplage de l'eNOS.
- Les effets de Lp(a) sur l'état redox et la signalisation inflammatoire se produisent localement dans la paroi vasculaire, sans lien avec les biomarqueurs inflammatoires systémiques.
Limitations et perspectives de l'étude
L'étude présente certaines limitations qui doivent être considérées pour des recherches futures.
- * Les échantillons ont été prélevés sur des patients subissant une chirurgie cardiaque, ce qui limite la généralisation des résultats.
- * La petite taille de l'échantillon et le nombre limité d'événements de résultats ont restreint les analyses de sous-groupes.
- * Des recherches supplémentaires sont nécessaires pour explorer les voies inflammatoires spécifiques à cibler chez les patients avec des niveaux élevés de Lp(a).
SYNTHÈSE / NOTEBOOK KLM
Le texte est un article de recherche originale publié dans la revue Arteriosclerosis, Thrombosis, and Vascular Biology de l'American Heart Association, portant sur la lipoprotéine (a) (Lp(a)) et l'état rédox vasculaire chez des patients atteints d'athérosclérose coronarienne avancée. L'étude, menée par Polkinghorne et al a utilisé un score de risque génétique (GRS) lié à la Lp(a) pour établir un lien causal et indépendant de l'ApoB entre l'augmentation de la Lp(a) plasmatique et le stress oxydatif artériel. Les résultats indiquent que l'augmentation de la Lp(a) est associée à un dysfonctionnement de l'eNOS (synthase de l'oxyde nitrique endothéliale), principalement chez les non-diabétiques, par une réduction de la biodisponibilité de la tétrahydrobioptérine. De plus, l'étude met en évidence que ce dysfonctionnement rédox est un mécanisme clé liant la Lp(a) à un risque accru de mortalité cardiovasculaire, validant ainsi des pistes pour de nouvelles cibles thérapeutiques.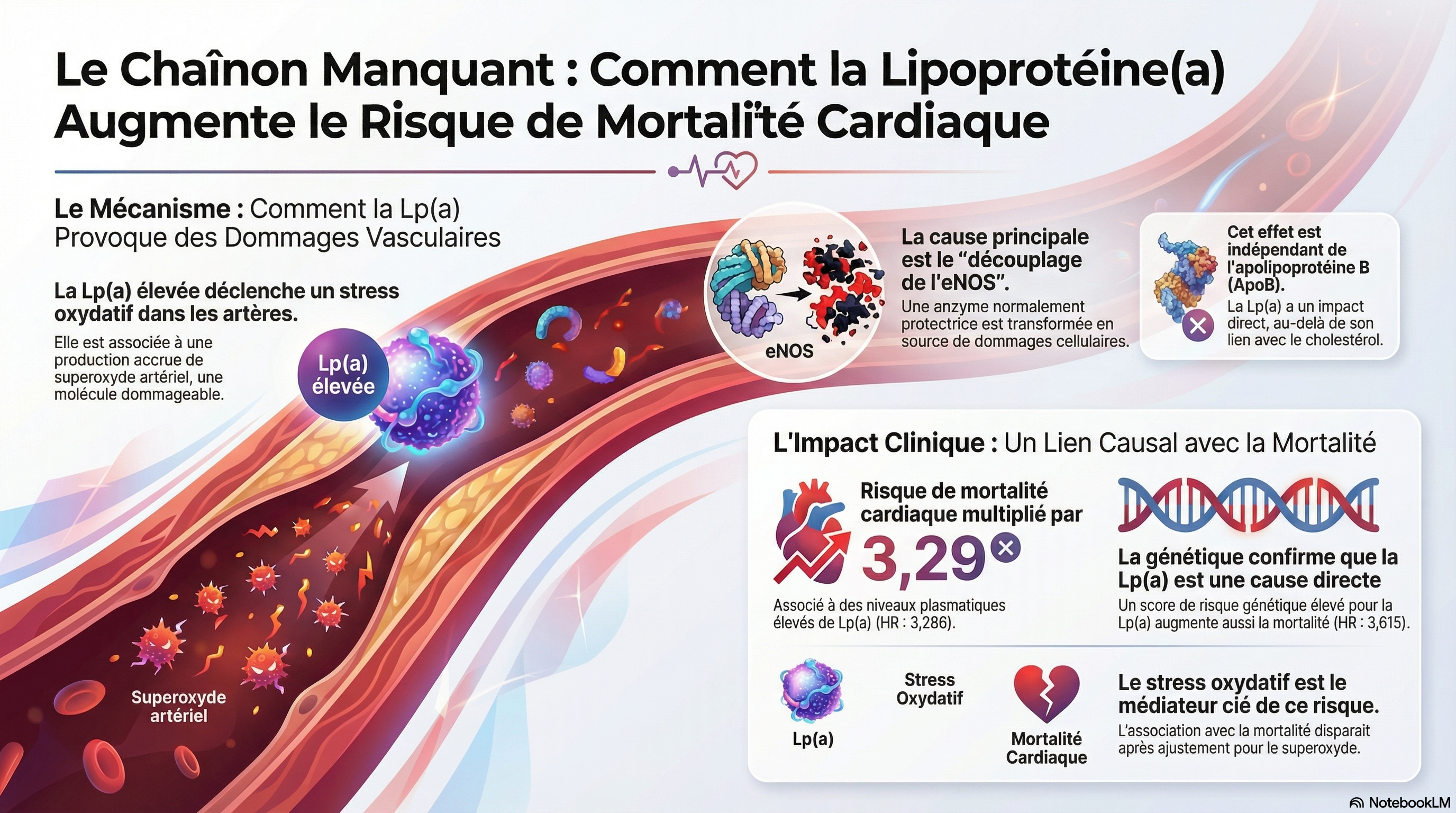
Commentaire
La Lp(a) est un facteur majeur de risque cardiovasculaire. Son dépistage universel
est un enjeu majeur de santé publique. L'état redox vasculaire pourra être un des paramètres pour les essais thérapeutiques qui abaissent la Lp(a). Un phénotype endothélial pro‑inflammatoire, pro‑athérogène et pro-thrombotique, tel est l'action de la Lp(a),qui explique son caractère délétère.
Affaire à suivre !
Copyright : Dr Jean-Pierre Laroche / 2025

