MTEV
-
Entretien avec Isabelle Mahé : Thrombose et cancer
 "L'esprit humain est plus fort que tout ce qui peut lui arriver." C.C. Scott
"L'esprit humain est plus fort que tout ce qui peut lui arriver." C.C. Scott
« Trois idéaux ont éclairé ma route et m'ont souvent redonné le courage d'affronter la vie avec optimisme : la bonté, la beauté et la vérité. » Albert Einstein
Thrombose et cancer : c'est au quotidien que nous sommes de plus en plus concernés par cette association, une liaison dangereuse, dont il faut écarter tous les pièges. Qui est le mieux placé aujourd'hui pour décrypter cette thématique ? Isabelle Mahé a bien voulu répondre à https://medvasc.info/. Merci Isabelle d'avoir accepté cet entretien.
Isabelle Mahé , Professeur des Universités, Praticien Hospitalier en Médecine Interne
Chef du service de Médecine Interne, Hôpital Louis Mourier, APHP, Université Paris Cité
INNOVTE-FCRIN, Cedex2 ,Saint EtienneEpidémiologie de la MTEV au cours du cancer actif et typologie (localisation, récurrence, risque hémorragique)
Avec les progrès notables des traitements anticancéreux ces dernières années, l’espérance de vie des patients avec cancer s’allonge. Dans le même temps, et dans le contexte des progrès réalisés en imagerie, l’incidence des événements thromboemboliques veineux associés au cancer progresse, quel que soit le site du cancer. Dans une étude récente, le risque thromboembolique chez les patients avec cancer a été estimé à 9 fois celui des patients sans cancer.Le risque thromboembolique veineux dépend du site et du stade du cancer, mais aussi des caractéristiques du patient et des traitements du cancer. Ainsi, les cancers du pancréas, gastrique, du poumon et les tumeurs cérébrales sont les plus à risque thromboembolique en risque relatif ; mais en terme d’effectifs, les patients avec cancers du sein, de la prostate et colorectal, en raison de leur prévalence élevée et bien qu’à moindre risque relatif de thrombose, sont les plus nombreux des patients avec thrombose et cancer.
Quel que soit le type de tumeur, la survenue d’un événement thromboembolique veineux est associée à un mauvais pronostic. Par ailleurs, après un premier épisode, sous traitement anticoagulant bien conduit, les patients avec cancer ont un risque majoré de développer une récidive veineuse thromboembolique et d’avoir des complications hémorragiques par rapport aux patients sans cancer.
Pendant longtemps les HBPM ont été le traitement référence de la MTEV au cours du cancer depuis l’étude CLOT. Aujourd’hui les choses changent, les AOD ont le vent en poupe. Qu’apportent les AOD par rapport aux HBPM dans ce contexte ?Par rapport aux HBPM administrés au long cours par voie injectable, les AOD ont l’avantage de la voie orale. Les HBPM sont longtemps restées la seule alternative thérapeutique recommandée chez les patients atteints de thrombose et cancer. Désormais, 2 alternatives s’offrent au prescripteur et au patient, HBPM et AOD, qui ne sont pas exclusives, puisque l’une ou l’autre des options peut être privilégiée au cours du suivi du patient selon le contexte et les préférences, ce qui est très positif.
Que reste-t-il des indications des HBPM en 2022 ?Les HBPM sont et restent une alternative de premier choix dans la prise en charge thérapeutique de la thrombose associée au cancer, comme cela a été rappelé dans la mise à jour des Recommandations Françaises en 2021 (https://doi.org/10.1016/j.
rmr.2021.03.001). De plus, chez les patients avec une insuffisance rénale sévère, situation où les AOD sont contre-indiqués, les HBPM sont privilégiées (Recommandations Françaises 2021).
La prévention de la MTEV au décours d’un cancer actif se pose régulièrement. Quelle est ta pratique à ce sujet ?Les patients avec cancer sont à risque thromboembolique veineux, à l’origine d’un surcroît de morbidité, de mortalité et de coûts de santé. Dans ce contexte, la thromboprophylaxie semble attractive.
Bien que les HBPM aient démontré une efficacité par rapport au placebo dans la prévention du risque thromboembolique veineux chez les patients avec cancer recevant une chimiothérapie en ambulatoire, leur prescription systématique n’est pas recommandée compte tenu de la réduction modeste du risque de survenue d’événement thromboembolique veineux, du risque hémorragique et de la contrainte de la voie injectable.
Plus récemment, les AOD ont été évalués prospectivement chez les patients avec cancer les plus à risque thromboembolique veineux (score de Khorana ≥2), mettant en évidence une réduction du risque thromboembolique veineux à 6 mois, au prix d’une augmentation significative du risque de saignements majeurs.
En pratique, en dehors du cas du myélome qui justifie une prophylaxie, la thromboprophylaxie doit être discutée au cas par cas devant les cancers les plus thrombogènes, en l’absence de facteur de risque hémorragique.
L’étude APICAT qui tu diriges est très attendue, peux-tu nous en rappeler la philosophie ?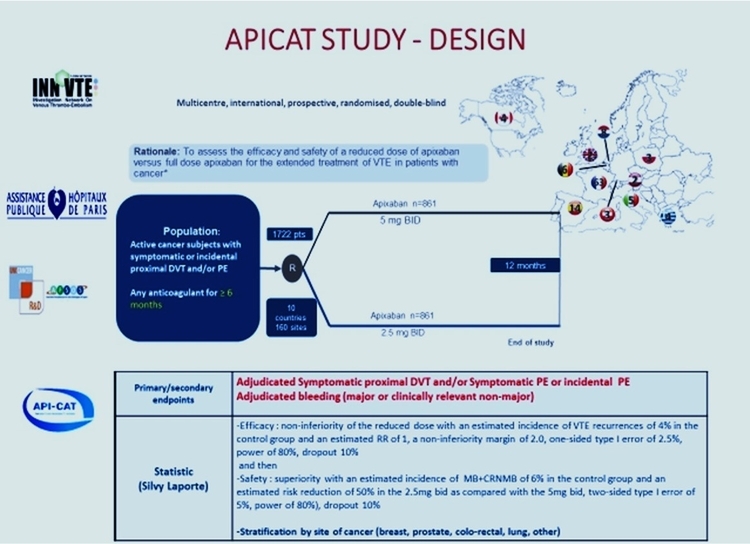
Mahé I, et al. Thromb Haemost 2021. doi: 10.1055/a-1647-9896Les essais thérapeutiques évaluant les différents schémas thérapeutiques d’anticoagulants chez des patients avec un cancer ont pour la plupart été menés avec une évaluation à 6 mois de l’événement index.
Avec les progrès des traitements anticancéreux et des soins de support, près de 60% des patients pris en charge pour un événement thromboembolique veineux associé à un cancer sont encore vivants 6 mois plus tard. La question de leur traitement se pose alors.
Après un épisode thromboembolique veineux dans un contexte de cancer, le risque de récidive est élevé, surtout dans les premières semaines suivant l’événement. Après 6 mois, ce risque persiste, même s’il est moins élevé que dans les 6 premiers mois alors que le risque hémorragique est significatif. Dans ce contexte, l'option d’une dose réduite d’anticoagulant semble attractive et justifie d'être évaluée prospectivement.
L’objectif principal de l’étude API-CAT (étude prospective randomisée en double aveugle) est d’évaluer la non infériorité sur le risque de récidive thrombo-embolique veineux d’une dose réduite d’anticoagulant (apixaban 2.5 mg X2/j) par rapport à la dose pleine (5 mg X2/j) chez des patients avec cancer actif ayant reçu au moins 6 mois d’anticoagulant pour un événement thrombo-embolique veineux ; si cet objectif est atteint, la supériorité de la dose réduite sur le risque hémorragique sera recherchée. L’analyse sera stratifiée selon le site de cancer.
A ce jour, plus de 1100 patients sur les 1722 patients attendus ont été inclus dans les 11 pays participant à l’étude.
Les AOD présentent des interactions avec les traitements du cancer. Peux-tu nous rappeler les interactions les plus dangereuses. Existe-t-il un ou des sites qui permettent en consultation lorsque que la prescription d’un AOD est possible d’éviter des associations à risqueLa question des interactions médicamenteuses entre AOD et anticancéreux est souvent évoquée. Elle peut s’envisager sous 2 angles ; le premier : peut-on attendre un effet de l’AOD sur l’effet antitumoral ? La réponse est non, il y a peu ou pas d’effet attendu de l’AOD sur l’effet du traitement antitumoral ; le deuxième : peut-on attendre un effet de l'anti tumoral sur l’effet de l’AOD ? La question se pose pour les traitements dont le métabolisme passe par le CYP3A4 et qui sont substrats de la P-gp. Dans la plupart des cas, l’intervalle thérapeutique large des AOD permet de ne pas anticiper d’impact clinique. La question reste posée pour les inhibiteurs/inducteurs puissants du 3A4 et de la P-gp, qui étaient des critères de non inclusion des essais thérapeutiques évaluant les AOD dans la thrombose associée au cancer. Il faut rappeler que pour ces situations, les données disponibles concernant les interactions n’ont pas été obtenues chez des patients.
https://cancer-<wbr< a=""> />druginteractions.org</wbr<>
https://www.afsos.org/fiche-
referentiel/prise-charge-de- maladie-thromboembolique- veineuse-cancerologie/
Les nouveaux AOD arrivent. Est-ce que les Anti XI par exemple ont été testés pour traiter la MTEV dans le cancer ou la prévenir ?Les anti XI semblent avoir un profil intéressant : en agissant au niveau du facteur XI, ces traitements permettent de prévenir le risque thromboembolique tout en minimisant le risque hémorragique.
A ce jour des données sont disponibles dans la prévention du risque thromboembolique dans la chirurgie du genou et la prévention du risque cardio-embolique dans la fibrillation auriculaire.
Un tel profil semble particulièrement attractif dans la prise en charge de la maladie veineuse thromboembolique associée au cancer. Des études prospectives randomisées sont sur le point de débuter en France dans la prise en charge initiale de la thrombose associée au cancer, avec un suivi à 6 mois.
Merci à Isabelle Mahé, des réponses claires, pour une meilleure connaissance sur THROMBOSE et CANCER, avec des retombées pratiques précieuses. -
Entretien avec l'autrice Géraldine Poénou (Hgie/Cancer/MTEV)
 "Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire." A Kirwan
"Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire." A Kirwan
« Presque tous les hommes meurent de leurs remèdes et non pas de leurs maladies. » MOLIÈRE (1622-1673), Le Malade imaginaire
Entretien ave Géraldine Poénou à propos de l'article
( inCancers 2022, 14, 1937. https://doi.org/10.3390/cancers14081937 Le point de départ :Les patients présentant des événements thromboemboliques veineux dans le cadre d'un cancer relèvent d’un traitement anticoagulant (quand il est possible) tant que le cancer est actif. De plus, malheureusement le cancer actif est autant un facteur de risque de récurrence d’événements thromboemboliques veineux qu’un facteur de risque hémorragique sous anticoagulant. Par conséquent, une stratégie d'anticoagulation sur mesure doit reposer sur une évaluation individualisée des risques de récidive thromboembolique veineuse et d'hémorragie associée aux anticoagulants. Aucun modèle d'évaluation des risques existant pour le risque de saignement associé aux anticoagulants n'a été validé pour la thrombose associée au cancer.
Le point de départ :Les patients présentant des événements thromboemboliques veineux dans le cadre d'un cancer relèvent d’un traitement anticoagulant (quand il est possible) tant que le cancer est actif. De plus, malheureusement le cancer actif est autant un facteur de risque de récurrence d’événements thromboemboliques veineux qu’un facteur de risque hémorragique sous anticoagulant. Par conséquent, une stratégie d'anticoagulation sur mesure doit reposer sur une évaluation individualisée des risques de récidive thromboembolique veineuse et d'hémorragie associée aux anticoagulants. Aucun modèle d'évaluation des risques existant pour le risque de saignement associé aux anticoagulants n'a été validé pour la thrombose associée au cancer.
Pour obtenir un meilleur modèle d'évaluation des risques, il semble nécessaire de se poser plusieurs questions que l'on a directement posé à Géraldine
Dr Géraldine Poénou@zudenstein
Assistante spécialiste en médecine vasculaire et thérapeutique
(Pr Laurent Bertoletti)
Service de Médecine Interne, Hôpital Louis Mourier, APHP Paris, Colombes
(Pr Isabelle Mahé)
Tout d’abord félicitations à toute l’équipe du Pr Isabelle Mahé pour cet article passionnant et très utile car il met en évidence des points majeurs sur l’anticoagulation de la MTEV au cours du cancer et notamment sur le risque hémorragique.
Le résumé graphique de l'article est hautement pertinent et didactique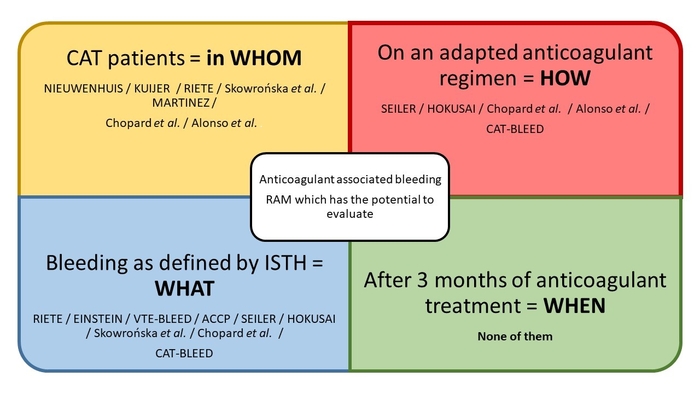
Alors première question : quelles sont les particularités du risque hémorragique, durant l’anticoagulation d’une MTEV au décours d’un cancer actif ?
Merci pour les félicitations, nous sommes tous très heureux des retours positifs que nous avons pour l’article ! Je pense que le plus important dans notre approche est que nous avons tenu à recentrer la question autours du patient : « Qu’est qui rend un patient souffrant de cancer ayant une MVTE sous anticoagulant plus à risque hémorragiquequ’un autre patient ? ». En se posant la question de cette façon cela force à se pencher, tout d’abord sur les caractéristiques intrinsèques du patient puis sa relation avec son environnement notamment thérapeutique.
Les caractéristiques intrinsèques du patient regroupent sa balance risque thrombotique/ risque hémorragique constitutionnelle propre à ce dernier (âge, situation à risques hémorragiques, insuffisance d’organe…) ainsi que les caractéristiques liées à son cancer (site, type, métastase…). Ces facteurs de risques sont immuables et doivent être recherché de manière systématique.
En association aux deux caractéristiques sus citées, il est important d’ajouter l’influence des traitements anticoagulant d’une part et des traitements anti cancéreux d’autre part. En effet, la sensibilité à certains traitements, ses propriétés pharmacologiques, sa toxicité et ses interactions médicamenteuses influent sur le risque hémorragique.
Si deux aspects sont systématiquement à évaluer chez tout patient ayant une MVTE (sa balance hémorragie/thrombose et son type de traitement anticoagulant) les particularités de notre patient dans cette situation est qu’il est nécessaire de prendre en compte aussi de manière de manière simultanée les caractéristiques liées à son cancer et l’impact de son traitement anticancéreux.
Le risque hémorragique dans ce contexte est il supérieur ou inférieur au risque de récidive de la MTEV ?Cette question à une réponse variable au cours du temps. D’après la littérature, chez un patient ayant une MTEV ce que l’on sait c’est qu’au moment du diagnostic risque de récidive et risque hémorragique sont égaux. Mais là où le risque de récidive diminue au fil des mois, le risque hémorragique reste constant sous anticoagulant et devient donc supérieur. C’est sur ce raisonnement qu’après la phase initiale de traitement, il est proposé une demi-dose en prévention des récidives de MVTE en population général. La même cinétique est observée chez les patients atteints de cancer. D’où l’idée de l’essai randomisé contrôlé international APICAT du Professeur Isabelle MAHÉ qui j’espère avec la participation active de tous permettra une limitation des expositions évitables à un surrisque hémorragique.
Dans cet article les différents scores de risque hémorragiques sont passés en revue. Pour mémoire il n’existe qu’un score de risque hémorragique Cancer et MTEV associé le score CAT-BLEED. Nous savons toutes et tous que les scores ont des limités ce que souligne la littérature et que le score parfait n’existe pas. Les items des scores sont plus pertinents. Alors quels seraient les paramètres les plus utiles dans la pratique quotidienne pour évaluer le risque hémorragique, en cas de MTEV/Cancer actif ?
Question difficile !La liste des facteurs influençant le risque hémorragique est longue voir fastidieuse pour une pratique en routine. Dans un monde idéal, il faudrait arriver à développer pour la pratique quotidienne une évaluation de la balance risque thrombotique/ risque hémorragiquerespectant la balance bénéficie/risque.
Cela passera potentiellement par l’intégration de nouveaux outils faciles d’emploi comme des biomarqueurs pour évaluer l’ensemble des éléments de l’équation « à quel risque hémorragique nous exposons les patients ? ».
Ce risque hémorragique est différent selon le type de cancer, sa localisation, les traitements du cancer et le traitement anticoagulant. Cette notion est très importante. Sans caricaturer le sujet quels sont les directions majeures à retenir des quatre questions : WHOM ? HOW ? WHAT ? WHEN ?WHOM ? => Comprendre qu’un patient cancéreux est à plus haut risque hémorragique et thrombotique que la population générale et donc doit être traité à part.
HOW? => Se rappeler qu’il est plus complexe dans sa prise en charge. Nous nous devons de trouver un moyen d’évaluer de manière globale l’addition des facteurs à prendre en compte.
WHAT? => Parler et mesurer la même chose. Nous nous devons de nous appuyer sur les critères tel que défini par l’ISTH pour parler d’hémorragie majeure, ou non majeure mais cliniquement pertinente.
WHEN? => Après 6 mois pour être plus bénéfique qu’à risque. La chose que nous souhaitons le plus en tant que médecin c’est d’abord le primum non nocere, il ne faut pas évaluer le traitement alors que ça non-prescription entrainerait une forte probabilité de décès. C’est après 6 mois de traitement, lorsque le risque de récidive est au plus bas, que l’évaluation prend tout son intérêt.
Compte tenu des bases de données sur cette thématique majeure, est ce que l’Intelligence Artificielle (Machine Learning) pourrait être d’une aide efficace ?
OUI ! L’individualisation ou personnalisation d’un traitement ne peut être que plus efficace via l’Intelligence Artificielle
Merci à toi Géraldine de nous avoir éclairé sur un sujet "délicat" auquel les médecins vasculaires sont confrontrés au quotidien.
Merci pour cet article qui pose les bonnes questions. Le réponses ne sont pas toutes au rendez-vous, la question du traitement anticoagulant devrait avancer avec les résultats de l’étude APICAT et d’autres.
Les RCP ONCO-THROMBOSE pour ces cas difficiles sont d'un grande aide. -
Entretien avec Marc Carrier : COVID-19 et MTEV
 "Le Canada est délimité au nord par l'or, à l'ouest par l'orient, à l'est par l'histoire et au sud par des amis" Frances Shelley Wees
"Le Canada est délimité au nord par l'or, à l'ouest par l'orient, à l'est par l'histoire et au sud par des amis" Frances Shelley Wees
« Advance - Ottawa - en Avant ». Devise de la ville d'Ottawa
Entretien avec Marc Carrier :Senior Scientist, Clinical Epidemiology Program
Ottawa Hospital Research Institute
Chief, Division of Hematology, Department of Medicine
The Ottawa Hospital
Professor, Department of Medicine
University of Ottawa
Marc Carrier est un éminenent spécialiste sur le maladie Vieneuse thrombo Embolique.
Il a publié entre 2011 et 2021 , 210 articles sur cette thématique dans les revues les plus prestigieuse.Cet entretien est centré sur la MTEV et la Covid-19Merci Marc , un grand Merci d'avoir répondu à mes questions et en francais
L’orage cytokinique qui est présent chez les patients Covid-19 en réanimation, comment est-il un activateur des phénomènes thrombotiques ?Excellente question. Je crois que l’entrée du virus dans la cellule endothéliale (exposition de facteur tissulaire), la cascade inflammatoire (relâche de cytokines) et l’orage cytokinique (activation du complément) sont tous des activateurs inter-reliés qui contribuent à la formation de thrombine, le dépôt de fibrine et les phénomènes thrombotiques.
A votre avis si la prévention par héparine de bas poids moléculaire est le médicament de la prévention de la maladie thrombo embolique en réanimation au décours de la Covid-19, à quelle dose ? Préventive ? Intermédiaire ? Ou curative ?
Pour l’instant, les données probantes semblent suggérer que les HBPM à dose préventive devraient être utilisées chez les patients en réanimation pour Covid-19. L’essai multi-plateforme randomisé (mRCT) qui a randomisé les patients avec Covid-19 en réanimation entre une dose d’héparine (majorité HBPM) thérapeutique et une dose standard (intermédiaire et préventive) n’a pas démontré de bénéfices sur le critère de jugement primaire de “Organ-support free days ». Les taux d’évènements thrombotiques (artériels et veineux) étaient moins élevés chez les patients recevant des dose thérapeutiques (5.7% vs. 10.3%) mais sans diminution de la morbidité et la mortalité. La prévention primaire à dose thérapeutique est aussi associée à une augmentation du risque hémorragique de 1.3% (définition de l’ISTH). L’étude iranienne INSPIRATION nous donne quelques indices pour décider entre une dose préventive et intermédiaire chez les patients en réanimation. Une dose intermédiaire n’a pas diminué le risque de survenue du critère de jugement principal (thromboses artérielles et veineuses, mortalité et traitement d’oxygénation extracorporelle) mais semble augmenter le risque hémorragique (définition de BARC; 2.5 vs 1.4%). Il y a donc peu de données randomisées en faveur d’une dose thérapeutique ou intermédiaire chez les patients Covid-19 en réanimation.
https://www.medrxiv.org/content/10.1101/2021.03.10.21252749v1
https://jamanetwork.com/journals/jama/fullarticle/2777829Pensez-vous que les anticoagulants oraux directs aient une place dans la prévention de la maladie thrombo embolique, chez les patients Covid-19 hospitalisés mais non en réanimation ?
Il y a plusieurs essais en cours et nous aurons peut-être une perspective différente dans les prochaines semaines ou mois. Pour l’instant l’étude ACTION, qui a comparé le rivaroxaban à une dose de 20 mg par jour (patients hospitalisés stables et au long cours (30 jours)) et l’énoxaparine 1 mg/kg BID (patients en réanimation) à une dose préventive (énoxaparine 40 mg par jour) pendant l’hospitalisation, n’a pas démontré de bénéfices mais une augmentation du risque hémorragique. Donc, pour l’instant, je ne crois pas que les anticoagulants oraux directs aient une place mais des études pré- et post-hospitalisation sont en cours et les données pourraient changer notre prise en charge. Il est possible que les héparines (HBPM ou non-fractionnée) puissent avoir d’autres fonctions (ex. diminution de l’entrée du virus, etc.) qui pourraient avoir des bénéfices chez les patients hospitalisés avec Covid-19
Pensez-vous que les D Dimères chez les patients hospitalisés en médecine et ou en réanimation en cas de Covid-10 puissent aider à moduler la gestion de la prévention de la thrombose en ce qui concerne sa posologie ?
Plusieurs études et essais en cours utilisent différents biomarqueurs (incluant les D-dimères) afin de stratifier les patients hospitalisés avec la Covid-19. Donc nous aurons plus d’information dans les prochains mois.
Au début de la pandémie, les niveaux élevés des D-dimères chez les patients hospitalisés semblaient être associés à une coagulopathie spécifique à la Covid-19. Maintenant, nous savons que les D-dimères peuvent être générés dans l’espace alvéolaire. L’écoulement de protéines plasmatiques (afin d’activer les cytokines) contient aussi de la thrombine et du fibrinogène qui éventuellement sera dégradé en D-dimères. Donc les D-dimères pourraient être un facteur pronostique de détérioration pulmonaire (et de mortalité) plutôt que d’un risque thrombo-embolique ou vasculaire.
L’essai mRCT n’a pas rapporté de différences importantes dans les odds-ratio favorisant une dose thérapeutique plutôt qu’une dose standard chez les patients hospitalisés (mais pas en réanimation) qui avaient des D-dimères élevés (2X la limite de la normale) ou non. Les odds ratios pour le critère de jugement principal (voir question 2) étaient de 1.3 (probabilité de 97%) et 1.2 (probabilité de 92%) chez les patients hospitalisés avec la Covid-19 (mais pas en réanimation) avec des D-dimères élevés ou non, respectivement. Donc pour l’instant, les données probantes semblent démontrer que les D-dimères ne sont pas très importants pour moduler la gestion de la thrombose chez les patients hospitalisés avec la Covid-19.
https://www.medrxiv.org/content/10.1101/2021.05.13.21256846v1
A. Khorana a évoqué dans un article du JTH, qu’il existait des ressemblances entre le Cancer et la Covid-19 en matière de maladie thrombo embolique veineuse, les 2 CC. Qu’en pensez-vous ?
Comme je suis un des auteurs de la publication, je suis un peu biaisé. Le but était de réviser la pathophysiologie de ces deux maladies pro-thrombo emboliques en donnant une perspective différente afin de générer une discussion et un débat. Je crois, en effet, qu’il y a des ressemblances intéressantes. Le risque thrombotique est élevé, les d-dimères sont très élevés et possiblement associé à un mauvais pronostic et la prévention primaire à dose de prophylactique semble insuffisante. Cependant, les différences entre les deux maladies (Cancer et COVID) permettent aussi aux cliniciens de réfléchir à la pathophysiologie sous-jacente et d’établir une prise en charge optimale afin de prévenir la malade thromboembolique chez ces patients. Je vous encourage à lire l’article :
https://onlinelibrary.wiley.com/doi/10.1111/jth.15294
Avez-vous été confronté dans votre pratique à des thromboses veineuses classiques, thrombose veineuse profonde des membres, thrombose veineuse superficielle et/ou embolie pulmonaire post vaccination anti Covid-19 et avec quel vaccin ?
C’est une excellente question. Comme la vaccination s’est accélérée dans les derniers mois au Canada, toutes les nouvelles TVP, thromboses superficielles et EP sont diagnostiquées chez des patients ayant récemment reçu la vaccination (Pfizer, Moderna et Astra-Zeneca). Cependant, nous avons eu quelques cas de thromboembolies veineuses dans le contexte de thrombocytopénie thrombotique associée au vaccin Astra-Zeneca. Tous les patients avaient des anticorps anti-PF4 positifs. Les immunoglobulines polyvalentes, les échanges plasmatiques et l’argatroban ont été utilisés avec succès dans la prise en charge de ces patients. Une série de cas Canadiens sera bientôt publiée afin de partager notre expérience clinique. Ce vaccin n’est plus utilisé au Canada et donc, nous avons eu aucun cas dans les dernières semaines.
MERCI
Une penseé pour Cleave Kearon -
EP sans TVP
 EP sans TVP , sur risque de mortalité !
EP sans TVP , sur risque de mortalité ! -
EP : obstruction résiduelle
 Commentaire de Grégoire Le Gal
Commentaire de Grégoire Le GalEvaluation du risque hémorragique sous traitement anticoagulant
 La solution : le Machine Learning
La solution : le Machine Learning
Facteur V Leiden "in extenso"
 Trop c'est trop !
Trop c'est trop !FAST TRACK BIBLIO 37 : des articles importants
 Veille bibliographique
Veille bibliographiqueFDR MTEV : anxiété et dépression
 TVP : nouveaux FDR
TVP : nouveaux FDRFormatage en Médecine : la solution
 MORPHEUS
MORPHEUSGrossesse et TVS
 TVS durant la grossesse
TVS durant la grossesseHémorragie ou récidive , telle est la question
 Décision médicale partagée
Décision médicale partagéeHibernation et MTEV
 LE SCOOP !
LE SCOOP !HSP47
 HSP47 OURS HIBERBNATION MTEV
HSP47 OURS HIBERBNATION MTEVIA et MTEV
 MTEV la révolution IA en marche
MTEV la révolution IA en marche
Immunothérapie et cancer : risque de MTEV
 “L'ambition est comme un médicament, il faut en prendre la dose prescrite, car elle peut être soit bénéfique, soit nocive.” Marc Allegret“Si le médicament ne porte pas le trouble et le désordre dans le corps d'un malade, il n'opérera pas la guérison.”MenciusRoopkumar J, Swaidani S, Kim AS, Thapa B, Gervaso L, Hobbs BP, Wei W, Alban TJ, Funchain P, Kundu S, Sangwan N, Rayman P, Pavicic PG Jr, Diaz-Montero CM, Barnard J, McCrae KR, Khorana AA. Increased Incidence of Venous Thromboembolism with Cancer Immunotherapy. Med. 2021 Apr 9;2(4):423-434. doi: 10.1016/j.medj.2021.02.002. Epub 2021 Mar 12. PMID: 34036293; PMCID: PMC8143033.Incidence accrue de la thromboembolie veineuse avec l'immunothérapie anticancéreuseArticle libre d'accés
“L'ambition est comme un médicament, il faut en prendre la dose prescrite, car elle peut être soit bénéfique, soit nocive.” Marc Allegret“Si le médicament ne porte pas le trouble et le désordre dans le corps d'un malade, il n'opérera pas la guérison.”MenciusRoopkumar J, Swaidani S, Kim AS, Thapa B, Gervaso L, Hobbs BP, Wei W, Alban TJ, Funchain P, Kundu S, Sangwan N, Rayman P, Pavicic PG Jr, Diaz-Montero CM, Barnard J, McCrae KR, Khorana AA. Increased Incidence of Venous Thromboembolism with Cancer Immunotherapy. Med. 2021 Apr 9;2(4):423-434. doi: 10.1016/j.medj.2021.02.002. Epub 2021 Mar 12. PMID: 34036293; PMCID: PMC8143033.Incidence accrue de la thromboembolie veineuse avec l'immunothérapie anticancéreuseArticle libre d'accés
L'immunothérapie anticancéreuse est associée à plusieurs événements indésirables liés au système immunitaire, mais la relation entre l 'immunothérapie et la thromboembolie veineuse n'a pas été étudiée en profondeur.
Méthodes
Nous avons mené une étude de cohorte rétrospective de 1 686 patients ayant reçu une immunothérapie pour une variété de tumeurs malignes afin de déterminer l'incidence de la thromboembolie veineuse et l'impact de la thromboembolie veineuse sur la survie.
Pour examiner le rôle potentiel de l'inflammation dans la thromboembolie veineuse, nous avons également profilé les cellules immunitaires et les cytokines plasmatiques dans des échantillons de sang obtenus avant le début de l'immunothérapie dans une sous-cohorte de patients traités dans le cadre d'essais cliniques qui l'ont fait par la suite (N = 15), ou l'ont fait pas (N = 10) développer une thromboembolie veineuse.Résultats
Une thromboembolie veineuse est survenue pendant l'immunothérapie chez 404/1686 patients (24 %) et a été associée à une diminution de la survie globale [HR = 1,22 (IC à 95 % 1,06–1,41), p < 0,008].
Les patients qui ont développé une thromboembolie veineuse avaient des niveaux de prétraitement significativement plus élevés de cellules suppressives myéloïdes (5,382 ± 0,873 vs 3,341 ± 0,3402, moyenne ± SEM ; p = 0,0045), d'interleukine 8 (221,2 ± 37,53 vs 111,6 ± 25,36, moyenne ± SEM; p = 0,016) et la protéine d'adhérence des cellules vasculaires solubles 1 (1210 ± 120,6 contre 895,5 ± 53,34, moyenne ± SEM ; p = 0,0385).
Conclusion
Ces résultats démontrent que la thromboembolie veineuse est un événement indésirable sous-estimé et important lié au système immunitaire associé à l'immunothérapie contre le cancer, et peut impliquer une voie induite par les cellules suppressives dérivées de l'interleukine 8 et de la myéloïde dans la pathogenèse.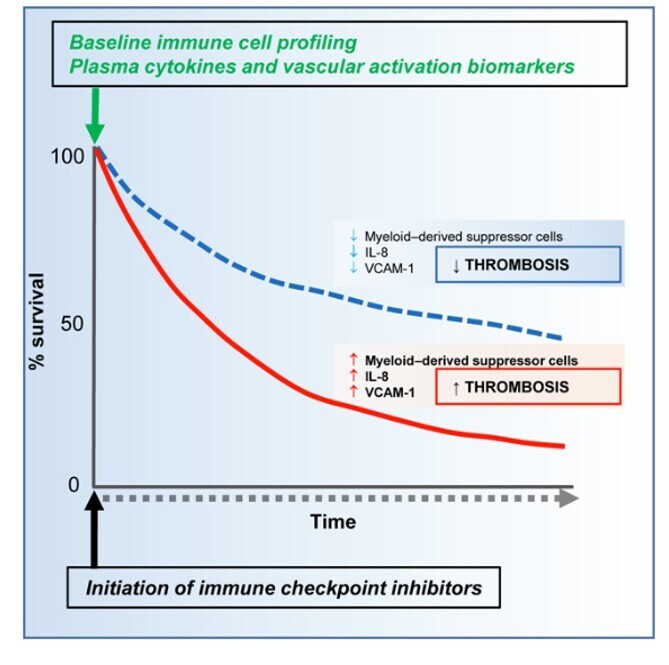
La thrombose veineuse est un événement indésirable sous-estimé associé à l'immunothérapie anticancéreuse. Roopkumar et al décrivent l'incidence de la thrombose veineuse chez les patients cancéreux recevant une immunothérapie et suggèrent que des niveaux élevés de cellules suppressives myéloïdes, d'interleukine 8 et de molécule d'adhésion cellulaire soluble 1 avant l'immunothérapie sont en corrélation avec le développement de la thrombose veineuse.
Points forts
L'immunothérapie anticancéreuse bloque les voies de régulation immunitaire physiologiques
Le blocage de la régulation immunitaire est associé à des événements indésirables liés au système immunitaireLa thrombose veineuse est un événement indésirable lié au système immunitaire sous-estiméDe nouveaux biomarqueurs peuvent prédire la thrombose chez les patients recevant une immunothérapie
L'immunothérapie est une nouvelle approche thérapeutique prometteuse du cancer.La clinique démontre que la thrombose veineuse (la formation de caillots sanguins dans les veines) survient chez jusqu'à 25 % des patients recevant ce traitement et doit donc être considérée comme un événement indésirable d'origine immunitaire courant chez les patients cancéreux traités par immunothérapie.
Les auteurs ont également identifié des biomarqueurs susceptibles de reconnaître les patients recevant une immunothérapie qui présentent le risque le plus élevé de thrombose.
Ces résultats suggèrent que la thrombose veineuse est une toxicité sous-estimée de l'immunothérapie anticancéreuse et pourraient guider de futures études axées sur la validation des biomarqueurs démontrés ici, ainsi que sur le rôle de l'anticoagulation prophylactique pour prévenir la thrombose chez les patients cancéreux à haut risque considérés pour l'immunothérapie
"Comprendre l’immunothérapie des cancers
DOSSIER INSERM complet sur ce sujet, à découvrir
L’immunothérapie agit sur le système immunitaire d’un patient pour l’aider à lutter contre sa maladie. Dans le cas du cancer, elle ne s’attaque pas directement à la tumeur, mais stimule les cellules immunitaires impliquées dans la reconnaissance et la destruction des cellules tumorales.L’immunothérapie a connu un boom en cancérologie au cours de ces dix dernières années, grâce à l’explosion des connaissances fondamentales sur l’immunologie du cancer. En effet, cette maladie n’est plus considérée du seul point de vue de la tumeur, mais aussi de celui de son environnement dans l’organisme et de ses interactions avec le système immunitaire. On sait désormais que c’est en manipulant cet ensemble que les cellules tumorales parviennent à proliférer hors de tout contrôle. En comprenant de mieux en mieux comment elles procèdent, les chercheurs peuvent aujourd’hui proposer de nouvelles solutions thérapeutiques."
https://www.inserm.fr/dossier/immunotherapie-cancers/#:~:text=L'immunoth%C3%A9rapie%20agit%20sur%20le,la%20destruction%20des%20cellules%20tumorales.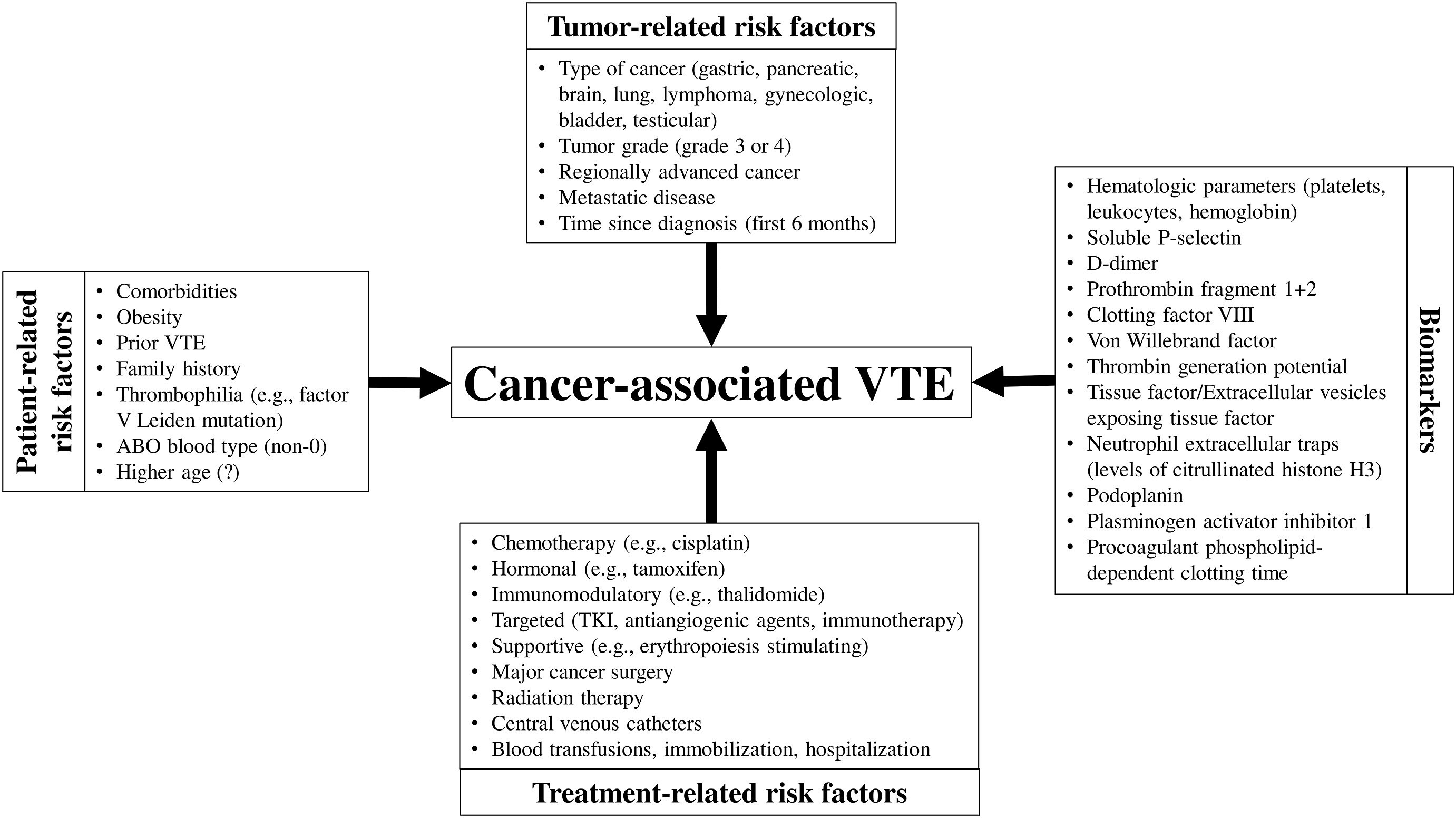
Facteurs de risque de MTEV associés au cancer.
https://www.sciencedirect.com/science/article/pii/S1521692622000020?via%3Dihub#fig1
"La prévention primaire de la MTEV (thromboprophylaxie) a longtemps été recommandée dans les milieux hospitaliers et post-chirurgicaux, et est maintenant une option en milieu ambulatoire pour les personnes atteintes d'un cancer à haut risque.L'anticoagulothérapie est la pierre angulaire du traitement, avec l'héparine de bas poids moléculaire ou des options plus récentes telles que les anticoagulants oraux directs. Un traitement personnalisé intégrant le risque de saignement et les préférences du patient est essentiel, d'autant plus qu'un diagnostic de MTEV est souvent considéré par les patients comme encore plus pénible que leur diagnostic de cancer, et peut gravement affecter la qualité de vie. Les recherches futures devraient se concentrer sur les lacunes actuelles dans les connaissances, notamment l'optimisation des outils d'évaluation des risques, la découverte de biomarqueurs, le développement d'anticoagulants de nouvelle génération et la science de la mise en œuvre."
Khorana, A.A., Mackman, N., Falanga, A. et al. Cancer-associated venous thromboembolism. Nat Rev Dis Primers 8, 11 (2022). https://doi.org/10.1038/s41572-022-00336-y
https://pubmed.ncbi.nlm.nih.gov/35177631/Commentaire
On doit considérer le cancer comme une thrombophilie acquise
La Maladie Thrombo-Embolique Veineuse (MTEV) est une complication fréquente du cancer. Son incidence est beaucoup plus élevée chez les patients atteints d’un cancer que dans la population générale (risque d’embolie pulmonaire ou de thrombose veineuse 5 fois plus élevé). La MTEV est ainsi la 2nde cause de décès chez les patients atteints de cancer.
La MTEV peut précéder un cancer (notamment lorsqu’elle survient de façon répétitive) ; révéler un diagnostic de cancer ou compliquer un cancer en cours de traitement.
https://www.oncobretagne.fr/groupes-techniques/thrombose-et-cancer/#:~:text=La%20Maladie%20Thrombo%2DEmbolique%20Veineuse,veineuse%205%20fois%20plus%20%C3%A9lev%C3%A9).
Le risque de MTEV au décours d'un cancer actif est majoré comme il l'est par la chirurgie du cancer, les chimiothérapies en générale, la radiothérappie, l'hormonothérapie ,l'immunotéhrapie et les thérapies ciblées.
En RCP ONCO THROMBOSE (CH Avignon) les dossiers présentés sont plus souvent sur l'anticoagulation sa poursuite et son arrêt. Par contre il n'est jamais évoqué des problèmes de prévention de la MTEV au décours du cancer en particulier du cancer en cours de traitement.......
Prévention MTEV et Cancer
https://www.portailvasculaire.fr/prevention-de-la-mtev-et-cancer

Thérapies ciblées
file:///E:/Downloads/Outil-therapies-ciblees-2014-V2%20(1).pdf
"La prescription des thérapies ciblées fait désormais partie du quotidien en oncologie médicale, mais les profils de tolérance de ces molécules innovantes sont différents de ceux bien connus avec les qualifiées conventionnelles.Parmi ces thérapies ciblées, certaines s'accompagnent d'effets vasculaires qui déroutent l'oncologue et orientent une population isolée de patients vers le médecin vasculaire.Les anti-angiogéniques par action anti-facteur de croissance endothélial vasculaire (bévacizumab, sunitinib , sorafénib, pazopanib) sont utilisés dans le traitement des cancers du rein, du sein, du côlon et de la thyroïde. Ils augmentent le risque de déséquilibre ou d'apparition d'une hypertension artérielle. Ils peuvent également être pourvoyeurs de microangiopathie thrombotique et plus largement, accroissent le risque de thromboses veineuses et artérielles et donc d'évènements cardiovasculaires."https://www.sciencedirect.com/science/article/abs/pii/S2542451317301116#:~:text=Ils%20augmentent%20le%20risque%20de,et%20donc%20d'%C3%A9v%C3%A8nements%20cardiovasculaires.
Compte tenu de cette majoration du risque de MTEV au décours des traitements des cancers, la prévention de la MTEV soit être une préoccupation majeure quotidienne.
Nous disposons de traitements efficaces , HBPM, AOD , en préventif ne pas hésiter à les prescrire en l'absence de contre indication. Situation difficile car le risque hémorragique est latent comme la fonction rénale, sans oublier les facteurs de comorbidité de ces patients et les interactions chimiothérapies (toutes confondues) en général et anticoagulant
A relire
https://www.ejinme.com/article/S0953-6205(22)00085-1/fulltext
Libre d'accés
Jiménez-Fonseca P, Gallardo E, Arranz Arija F, Blanco JM, Callejo A, Lavin DC, Costa Rivas M, Mosquera J, Rodrigo A, Sánchez Morillas R, Vares Gonzaléz M, Muñoz A, Carmona-Bayonas A. Consensus on prevention and treatment of cancer-associated thrombosis (CAT) in controversial clinical situations with low levels of evidence. Eur J Intern Med. 2022 Jun;100:33-45. doi: 10.1016/j.ejim.2022.02.020. Epub 2022 Feb 26. PMID: 35227541.
https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(22)00160-7/fulltextLibre d'accés
Farge D, Frere C, Connors JM, Khorana AA, Kakkar A, Ay C, Muñoz A, Brenner B, Prata PH, Brilhante D, Antic D, Casais P, Guillermo Esposito MC, Ikezoe T, Abutalib SA, Meillon-García LA, Bounameaux H, Pabinger I, Douketis J; International Initiative on Thrombosis and Cancer (ITAC) advisory panel. 2022 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer, including patients with COVID-19. Lancet Oncol. 2022 Jul;23(7):e334-e347. doi: 10.1016/S1470-2045(22)00160-7. PMID: 35772465; PMCID: PMC9236567.Inflammasome et MTEV
INFO PATIENT MTEV (USA)
 De la lecture pour les patients
De la lecture pour les patientsINNOVTE CAT / Indroductions
 Des RECOS majeures
Des RECOS majeuresINNOVTE CAT / Patients fragiles
 Fragilité, ne jamais la sous estimer
Fragilité, ne jamais la sous estimer

